Rhinocort 100 microgrammi/erogazione polvere nasale
budesonide
Elenco capitoli
- CATEGORIA FARMACOTERAPEUTICA
- INDICAZIONI TERAPEUTICHE
- CONTROINDICAZIONI
- PRECAUZIONI PER L’USO
- INTERAZIONI
- AVVERTENZE SPECIALI
- EFFETTI INDESIDERATI
- SCADENZA E CONSERVAZIONE
- COMPOSIZIONE
- FORMA FARMACEUTICA E CONTENUTO
CATEGORIA FARMACOTERAPEUTICA
Preparato rinologico per uso topico a base di corticosteroide.
INDICAZIONI TERAPEUTICHE
Riniti allergiche stagionali, riniti perenni allergiche e non allergiche.
CONTROINDICAZIONI
Ipersensibilità a budesonide.
PRECAUZIONI PER L’USO
L’uso di dosi eccessive o un trattamento prolungato con glucocorticosteroidi può comportare la comparsa di segni o sintomi di ipercorticismo, soppressione della funzione dell’asse ipotalamo-ipofisi-surrenale e/o soppressione della crescita nei bambini.
E’ importante assumere la dose di farmaco come indicato nel foglio illustrativo o come prescritto dal medico. Si deve usare solo la dose di farmaco raccomandata dal medico; l’uso di dosi maggiori o minori può causare un peggioramento dei sintomi.
Si possono presentare effetti sistemici con i corticosteroidi intranasali, in particolare quando prescritti ad alte dosi per periodi prolungati. Tali effetti si verificano con minore probabilità rispetto al trattamento con corticosteroidi orali e possono variare nei singoli pazienti e tra le differenti preparazioni di corticosteroidi. I possibili effetti sistemici includono la sindrome di Cushing, aspetto Cushingoide, soppressione surrenalica, ritardo della crescita in bambini e adolescenti, riduzione della densità minerale ossea, cataratta, glaucoma e più raramente una serie di effetti psicologici o comportamentali che includono iperattività psicomotoria, disturbi del sonno, ansietà depressione o aggressività (particolarmente nei bambini).
I medici curanti devono controllare attentamente la crescita dei bambini che assumono glucocorticosteroidi per tempi protratti per qualsiasi via di somministrazione e devono valutare il beneficio di una terapia glucocorticosteroidea verso il rischio di una possibile soppressione della crescita.
Una ridotta funzionalità epatica può influenzare l’eliminazione dei glucocorticosteroidi, causando una ridotta velocità di eliminazione e una esposizione sistemica più elevata. Tenere in considerazione la possibilità di effetti collaterali sistemici. La farmacocinetica di budesonide somministrata per via endovenosa è simile nei pazienti con cirrosi e nei soggetti sani; quando budesonide è somministrata per via orale la farmacocinetica viene influenzata dalla compromissione della funzionalità epatica con aumento della disponibilità sistemica. Quanto riportato ha una ripercussione clinica limitata per Rhinocort in quanto, dopo l’inalazione del prodotto, il contributo orale alla disponibilità sistemica è relativamente basso.
Speciali considerazioni sono necessarie nel caso di pazienti con tubercolosi polmonare, attiva o quiescente e in pazienti con infezioni fungine o virali delle vie respiratorie.
INTERAZIONI
Informare il medico o il farmacista se si è recentemente assunto qualsiasi altro medicinale, anche quelli senza prescrizione medica.
Non sono state osservate interazioni tra budesonide ed altri farmaci utilizzati per il trattamento delle riniti.
Il metabolismo di budesonide è mediato prevalentemente dal CYP3A4, un isoenzima del citocromo P450. Gli inibitori di questo enzima, quali ketoconazolo e itraconazolo, possono quindi aumentare di diverse volte l’esposizione sistemica a budesonide.
Non essendo disponibili dati per avvalorare una raccomandazione relativa al dosaggio bisogna evitare la combinazione di questi farmaci. Se questo non fosse possibile, bisogna far trascorrere il più lungo intervallo di tempo possibile tra i due trattamenti e si potrebbe prendere in considerazione di ridurre la dose di budesonide. Sono state rilevate concentrazioni plasmatiche elevate ed effetti potenziati dei corticosteroidi nelle donne trattate anche con estrogeni e steroidi contraccettivi, mentre non è stato osservato alcun effetto con l’impiego di budesonide e l’assunzione concomitante di contraccettivi orali a basse dosi.
1
A causa della soppressione surrenalica, il test di stimolazione con ACTH per la diagnosi dell’insufficienza corticosurrenalica potrebbe dare falsi risultati (bassi valori).
Alle dosi raccomandate cimetidina ha un leggero effetto, clinicamente irrilevante, sulla farmacocinetica di budesonide somministrata per via orale.
AVVERTENZE SPECIALI
Per chi svolge attività sportiva
L’uso del farmaco senza necessità terapeutica costituisce doping e può determinare comunque positività ai test antidoping.
Gravidanza e allattamento
Chiedere consiglio al medico o al farmacista prima di prendere qualsiasi medicinale.
I risultati ricavati da studi epidemiologici prospettici e dall’esperienza post-marketing su scala mondiale non evidenziano un aumentato rischio di malformazioni congenite nell’uomo associato all’uso inalatorio o intranasale di budesonide durante i primi mesi di gravidanza.
Come per altri farmaci la somministrazione di budesonide durante la gravidanza richiede la valutazione dei benefici terapeutici della madre verso i rischi per il feto.
Budesonide è escreta nel latte materno. Tuttavia, alle dosi terapeutiche di budesonide, non sono attesi effetti sul lattante. Budesonide può essere impiegata durante l’allattamento.
La terapia di mantenimento con budesonide per via inalatoria (200 o 400 microgrammi due volte al giorno) nelle donne asmatiche in allattamento determina un’esposizione sistemica a budesonide trascurabile nell’infante allattato al seno.
Nell’ambito di uno studio di farmacocinetica, la dose giornaliera stimata nel lattante era pari allo 0,3% della dose giornaliera assunta dalla madre per entrambi i livelli di dosaggio e la media delle concentrazioni plasmatiche nel lattante è stata stimata essere 1/600 delle concentrazioni osservate nel plasma materno, presupponendo una completa biodisponibilità orale nel lattante. Le concentrazioni di budesonide nei campioni di plasma del lattante sono sempre risultate al di sotto dei limiti di quantificazione.
Basandosi sui dati ottenuti con l’impiego di budesonide per via inalatoria e sul fatto che budesonide mostra un profilo farmacocinetico lineare entro l’intervallo di dosi terapeutiche dopo la somministrazione per via nasale, inalatoria, orale e rettale, alle dosi terapeutiche di budesonide, l’esposizione del lattante è presumibilmente bassa.
Effetti sulla capacità di guidare veicoli e sull’uso di macchinari
Rhinocort non altera la capacità di guidare veicoli o di utilizzare macchinari.
DOSE, MODO E TEMPO DI SOMMINISTRAZIONE
La posologia va adattata al singolo paziente e va ridotta fino a raggiungere la dose minima che permetta il controllo della sintomatologia.
Adulti ed anziani: la dose iniziale consigliata è di 400 microgrammi al mattino somministrati con due applicazioni in ciascuna narice.
Non vi sono dati che indichino che una dose giornaliera superiore a 400 microgrammi aumenti l’efficacia.
Una volta raggiunti i risultati clinici desiderati, generalmente in 1 o 2 settimane, la dose di mantenimento deve essere ridotta alla quantità minima di prodotto che permetta il controllo della sintomatologia.
Popolazione pediatrica:
Non ci sono dati sufficienti per raccomandare l’uso di Rhinocort 100 microgrammi/erogazione polvere nasale nei bambini (vedere “Precauzioni per l’uso”).
2
Un trattamento concomitante può a volte rendersi necessario per controllare i sintomi oculari causati dall’allergia.
Se il passaggio nasale dovesse essere bloccato possono essere utilizzati dei vasocostrittori nasali durante i primi 2-3 giorni di trattamento.
Il paziente deve essere informato del fatto che soltanto dopo un trattamento di alcuni giorni si ottiene l’effetto completo di budesonide. Il trattamento della rinite stagionale deve, se possibile, iniziare prima dell’esposizione agli allergeni.
Istruzioni per l’uso / la manipolazione
Legga attentamente le istruzioni complete prima di iniziare a prendere il medicinale
Turbohaler è un inalatore multidose tramite il quale vengono somministrate piccole quantità di polvere (Figura 1). Quando inspira con il naso attraverso

Adattatore nasale l’inalatore il medicinale viene distribuito alle vie nasali dove agisce.
COME
Indicatore PREPARARE UN NUOVO INALATORE PRIMA DELL’USO
Prima Rotella di utilizzare Turbohaler per la prima volta
è necessario preparare l’inalatore per l’uso.
Svitare e rimuovere il cappuccio.
Figura 1
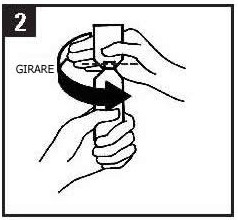
Tenere l’inalatore in posizione verticale con la rotella rivolta verso il basso (Figura 2). Non afferrare l’adattatore nasale quando gira la rotella. Girare la rotella in un senso fino a fondo corsa, e poi girare nell’altro senso ancora fino a fondo corsa. Non è importante in che direzione si giri la rotella la prima volta.

Durante questa procedura si sentirà un clic.
Figura 2
L’inalatore è ora pronto per l’uso, e non si deve ripetere tale procedura di preparazione di nuovo.
Per somministrare una dose, continuare secondo le istruzioni riportate di seguito.

3

4

SOVRADOSAGGIO
Un sovradosaggio acuto di Rhinocort, anche a dosi molto elevate, non si ritiene possa causare problemi clinici.
In caso di ingestione/assunzione accidentale di una dose eccessiva di Rhinocort avvertite immediatamente il medico o rivolgetevi al più vicino ospedale.
SE SI HA QUALSIASI DUBBIO SULL’USO DI RHINOCORT, RIVOLGERSI AL MEDICO O AL FARMACISTA.
5
EFFETTI INDESIDERATI
Come tutti i medicinali, Rhinocort può causare effetti indesiderati, sebbene non tutte le persone li manifestino.
Si possono presentare effetti sistemici con i corticosteroidi intranasali, in particolare se prescritti ad alte dosi per periodi prolungati.
Le seguenti definizioni si riferiscono all’incidenza di effetti indesiderati:
Le frequenze sono definite come: molto comune (>1/10), comune (da >1/100 a <1/10), non comune (da >1/1.000 a <1/100), raro (da >1/10.000 a <1/1.000), molto raro (<1/10.000).

Possono insorgere effetti sistemici dei corticosteroidi somministrati per via nasale, specialmente ad alte dosi in caso di impiego per lunghi periodi di tempo (vedere paragrafo “Precauzioni per l’uso”).
Popolazione pediatrica
Ritardo nella crescita è stato riportato in bambini in trattamento con steroidi per via intranasale.
Dato il rischio di rallentamento della crescita nella popolazione dei pazienti pediatrici, la crescita deve essere monitorata (vedere paragrafo “Precauzioni per l’uso”).
Il rispetto delle istruzioni contenute nel foglio illustrativo riduce il rischio di effetti indesiderati.
Se uno qualsiasi degli effetti indesiderati si aggrava, o se nota la comparsa di un qualsiasi effetto indesiderato non elencato in questo foglio illustrativo, informi il medico o il farmacista.
SCADENZA E CONSERVAZIONE
Scadenza: vedere la data di scadenza riportata sulla confezione.
La data di scadenza indicata si riferisce al prodotto in confezionamento integro, correttamente conservato.
Attenzione: non utilizzare il medicinale dopo la data di scadenza riportata sulla confezione.
Non conservare al di sopra di 30°C. Conservare con il cappuccio ben chiuso.
I medicinali non devono essere gettati nell’acqua di scarico e nei rifiuti domestici. Chieda al farmacista come eliminare i medicinali che non utilizza più. Questo aiuterà a proteggere l’ambiente.
Tenere il medicinale fuori dalla portata e dalla vista dei bambini.
6
COMPOSIZIONE
L’erogatore contiene:
Principio attivo: budesonide 20 mg.
Eccipienti: il prodotto non contiene eccipienti.
FORMA FARMACEUTICA E CONTENUTO
Polvere nasale.
Rhinocort 100 microgrammi/erogazione polvere nasale-un erogatore Turbohaler da 200 dosi
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
AstraZeneca S.p.A.
Palazzo Volta
Via F. Sforza
Basiglio (MI)
PRODUTTORE
Prodotto, confezionato e controllato da:
AstraZeneca AB-Södertälje (Svezia)
REVISIONE DEL FOGLIO ILLUSTRATIVO DA PARTE DELL’AGENZIA ITALIANA DEL FARMACO:
Agosto 2013
AZ2586F
7