DOLMEN 20 mg COMPRESSE RIVESTITE CON FILM
DOLMEN 20 mg SUPPOSTE
DOLMEN 20 mg GRANULATO PER SOSPENSIONE ORALE
DOLMEN 20 mg/2 mL POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE
DOLMEN 40 mg/2 mL POLVERE E SOLVENTE PER SOLUZIONE INIETTABILE PER USO INTRAMUSCOLARE
tenoxicam
Elenco capitoli
- COMPOSIZIONE
- CONFEZIONI
- INDICAZIONI
- CONTROINDICAZIONI
- PRECAUZIONI D’IMPIEGO
- INTERAZIONI
- AVVERTENZE SPECIALI
- EFFETTI INDESIDERATI
COMPOSIZIONE
DOLMEN 20 mg compresse rivestite con film
Una compressa contiene: Principio attivo: tenoxicam 20 mg. Eccipienti: lattosio, amido di mais, talco, magnesio stearato, idrossipropilmetilcellulosa, titanio biossido, ferro ossido giallo E 172.
DOLMEN 20 mg supposte
Una supposta contiene: Principio attivo: tenoxicam 20 mg. Eccipienti: gliceridi semisintetici solidi, propilenglicole stearato, ricinoleato di glicerina etossilata.
DOLMEN 20 mg granulato per sospensione orale
Una bustina contiene: Principio attivo: tenoxicam 20 mg. Eccipienti: latte magro polvere, aspartame, etilvanillina.
DOLMEN 20 mg/2 mL polvere e solvente per soluzione iniettabile
Una fiala di polvere contiene: Principio attivo: tenoxicam 20 mg. Eccipienti: mannite, sodio idrossido, trometamolo, acido ascorbico, sodio edetato.
Una fiala di solvente contiene: acqua per preparazioni iniettabili 2 mL.
DOLMEN 40 mg/2 mL polvere e solvente per soluzione iniettabile per uso intramuscolare
Una fiala di polvere contiene: Principio attivo: tenoxicam 40 mg. Eccipienti: mannite, sodio idrossido, trometamolo, acido ascorbico, sodio edetato.
Una fiala di solvente contiene: acqua per preparazioni iniettabili 2 mL.
CONFEZIONI
DOLMEN 20 mg compresse rivestite con film: 20 compresse
DOLMEN 20 mg compresse rivestite con film: 30 compresse
DOLMEN 20 mg supposte: 10 supposte
DOLMEN 20 mg granulato per sospensione orale: 30 bustine
DOLMEN 20 mg/2 mL polvere e solvente per soluzione iniettabile: 1 fiala di polvere + 1 fiala solvente da 2 mL
DOLMEN 20 mg/2 mL polvere e solvente per soluzione iniettabile: 2 fiale di polvere + 2 fiale solvente da 2 mL
DOLMEN 20 mg/2 mL polvere e solvente per soluzione iniettabile: 6 fiale di polvere + 6 fiale solvente da 2 mL
DOLMEN 40 mg/2 mL polvere e solvente per soluzione iniettabile per uso intramuscolare: 2 fiale di polvere + 2 fiale solvente da 2 mL
CATEGORIA TERAPEUTICA
DOLMEN appartiene alla categoria terapeutica dei farmaci antinfiammatori ed antireumatici non steroidei, derivati dell’oxicam.
NOME ED INDIRIZZO DEL TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO E DEL PRODUTTORE
SIGMA-TAU Industrie Farmaceutiche Riunite S.p.A.
Viale Shakespeare, 47-00144 Roma
Stabilimento: Via Pontina km 30,400-00040 Pomezia (Roma)
INDICAZIONI
Trattamento sintomatico di affezioni reumatiche, infiammatorie e degenerative.
La formulazione fiale è particolarmente indicata nel trattamento sintomatico degli episodi dolorosi acuti in atto nel corso di affezioni infiammatorie dell’apparato muscolo-scheletrico.
CONTROINDICAZIONI
DOLMEN non deve essere somministrato a pazienti con storia di emorragia gastrointestinale o perforazione relativa a precedenti trattamenti attivi o storia di emorragia/ulcera peptica ricorrente (due o più episodi distinti di dimostrata ulcerazione o sanguinamento).
DOLMEN non deve essere usato nei soggetti che hanno dimostrato ipersensibilità al farmaco o verso qualcuno degli eccipienti o sostanze strettamente correlate dal punto di vista chimico, né in presenza di ulcera gastro-intestinale, gastrite, dispepsie, gravi disturbi epatici e renali, grave insufficienza cardiaca, grave ipertensione, alterazioni ematiche gravi, in corso di terapia diuretica intensiva, in soggetti con emorragie in atto o diatesi emorragica, né in corso di trattamento con anticoagulanti in quanto ne sinergizza l’azione. Esiste la possibilità di sensibilità crociata con acido acetilsalicilico o altri farmaci antinfiammatori non steroidei. DOLMEN non deve essere somministrato ai pazienti nei quali l’acido acetilsalicilico o altri farmaci antinfiammatori non steroidei provochino sintomi di asma, rinite od orticaria. Il prodotto non deve essere somministrato a pazienti che debbono essere sottoposti ad interventi chirurgici o ad anestesia. Soggetti di età inferiore a 15 anni.
DOLMEN 20 mg granulato per sospensione orale non deve essere somministrato a soggetti con intolleranza al latte o ai suoi derivati (vedere “Precauzioni d’impiego”), inoltre per la presenza di aspartame, il granulare è controindicato nei pazienti affetti da fenilchetonuria.
Gravidanza ed allattamento (vedere “Gravidanza ed allattamento”).
PRECAUZIONI D’IMPIEGO
In pazienti con anamnesi positiva per affezioni della parte alta del tratto gastrointestinale, DOLMEN
può essere somministrato solo sotto stretto controllo medico.
I pazienti anziani hanno un aumento della frequenza di reazioni avverse ai FANS, specialmente emorragie e perforazioni gastrointestinali, che possono essere fatali (vedere “Effetti indesiderati”).
Durante il trattamento con tutti i FANS, in qualsiasi momento, con o senza sintomi di preavviso o precedente storia di gravi eventi gastrointestinali, sono state riportate emorragia gastrointestinale, ulcerazione e perforazione, che possono essere fatali.
Negli anziani ed in pazienti con storia di ulcera, soprattutto se complicata da emorragia o perforazione (vedere “Controindicazioni”), il rischio di emorragia gastrointestinale, ulcerazione o perforazione è più alto con dosi aumentate di FANS. Questi pazienti devono iniziare il trattamento con la più bassa dose disponibile. L’uso concomitante di agenti protettori (misoprostolo o inibitori di pompa protonica) deve essere considerato per questi pazienti e anche per pazienti che assumono basse dosi di aspirina o altri farmaci che possono aumentare il rischio di eventi gastrointestinali (vedi sotto e vedere “Interazioni”).
Pazienti con storia di tossicità gastrointestinale, in particolare anziani, devono riferire qualsiasi sintomo gastrointestinale inusuale (soprattutto emorragia gastrointestinale) in particolare nelle fasi iniziali del trattamento.
Cautela deve essere prestata ai pazienti che assumono farmaci concomitanti che potrebbero aumentare il rischio di ulcerazione o emorragia, come corticosteroidi orali, anticoagulanti come warfarin, inibitori selettivi del reuptake della serotonina o agenti antiaggreganti come l’aspirina (vedere “Interazioni”).
Quando si verifica emorragia o ulcerazione gastrointestinale in pazienti che assumono DOLMEN, il trattamento deve essere sospeso.
I FANS devono essere somministrati con cautela nei pazienti con storia di malattia gastrointestinale (colite ulcerosa, morbo di Crohn, poiché tali condizioni possono essere esacerbate (vedere “Effetti indesiderati”).
Occorre cautela nei pazienti con una storia di ipertensione e/o insufficienza cardiaca poiché, in associazione alla terapia con FANS, sono state riportate ritenzione idrica e edema.
Particolare cautela deve essere adottata anche nel trattamento di soggetti che presentino funzionalità epatica o renale ridotta, alterazioni ematiche in atto o pregresse, asma bronchiale e di soggetti in età avanzata.
Come altri farmaci ad attività analoga, tenoxicam inibisce la sintesi renale delle prostaglandine e quindi possono verificarsi degli effetti indesiderati sull’emodinamica renale e sul bilancio sodio idrico. In particolari gruppi di pazienti a rischio di sviluppo di insufficienza renale (anziani o soggetti con affezioni renali preesistenti, diabete, cirrosi epatica, insufficienza cardiaca scompensata, ipovolemia, concomitante trattamento con diuretici o con farmaci a potenziale nefrotossico noto) è necessario monitorare con attenzione la funzionalità cardiaca e renale (BUN, creatinina, sviluppo di edemi, perdita di peso, ecc.). Sono stati osservati in alcuni pazienti aumenti dell’azotemia che non progrediscono, con il protrarsi della terapia, oltre un certo livello. Ritornano ai valori normali una volta sospesa la terapia.
DOLMEN, come altri farmaci antinfiammatori non steroidei, diminuisce l’aggregazione piastrinica ed interferisce sui processi di emostasi; DOLMEN, peraltro, non influenza significativamente i fattori di coagulazione ematica, il tempo di coagulazione, di protrombina o della tromboplastina. Queste eventualità vanno ricordate, quando si effettuano prove ematologiche ed impongono vigilanza in pazienti con disordini della coagulazione o in trattamento contemporaneo con farmaci che inibiscono l’aggregazione piastrinica.
Poiché sono stati riportati degli effetti indesiderati di tipo oftalmico, si raccomanda un’adeguata valutazione, in pazienti sottoposti a trattamento con tenoxicam, in caso di comparsa di tali fenomeni.
Eruzioni cutanee potenzialmente letali (sindrome di Stevens-Johnson, necrolisi epidermica tossica) sono state segnalate con l’uso di DOLMEN, queste appaiono inizialmente come macchie rosse rotonde o chiazze circolari che spesso si accompagnano a vesciche nella parte centrale del tronco.
Ulteriori segni da notare comprendono ulcere nella bocca, gola, naso, genitali e congiuntivite (occhi rossi e gonfi).
Queste eruzioni cutanee potenzialmente letali per la vita sono spesso accompagnate da sintomi simil-influenzali. L’eruzione può regredire con lo sviluppo di vesciche diffuse o esfoliazione della pelle.
Il più alto rischio di comparsa di reazioni cutanee gravi si verifica entro le prime settimane di trattamento.
Se avete sviluppato la sindrome di Stevens-Johnson o la necrolisi epidermica tossica, con l’uso di
DOLMEN, il DOLMEN non deve essere più riutilizzato.
Se si sviluppa un rash cutaneo o questi sintomi cutanei, interrompere l’assunzione di DOLMEN,
consultare con urgenza un medico e informarlo che si sta assumendo questo farmaco.
Come altri farmaci antinfiammatori non steroidei, tenoxicam maschera i comuni segni di infezione.
L’uso di DOLMEN, come di qualsiasi farmaco inibitore della sintesi delle prostaglandine e della ciclo-ossigenasi, è sconsigliato nelle donne che intendano iniziare una gravidanza.
La somministrazione di DOLMEN dovrebbe essere sospesa nelle donne che hanno problemi di fertilità o che sono sottoposte ad indagini sulla fertilità.
DOLMEN 20 mg granulato per sospensione orale contiene latte magro in polvere come eccipiente, conseguentemente questa forma farmaceutica non deve essere somministrata a soggetti con intolleranza al latte o ai suoi derivati.
Le compresse contengono lattosio quindi i pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit di lattasi, o da malassorbimento di glucosio-galattosio, non devono assumere questo medicinale.
TENERE IL MEDICINALE FUORI DALLA PORTATA E DALLA VISTA DEI BAMBINI
INTERAZIONI
Dato che il principio attivo si trova, dopo la somministrazione, in gran parte (99%) legato con proteine, non può essere completamente escluso uno spiazzamento da altri farmaci con elevato legame farmacoproteico.
Pertanto, qualora DOLMEN venga associato ad altri farmaci altamente legati a proteine plasmatiche, deve esservi un accurato controllo medico per poter eventualmente adeguare le dosi.
Le seguenti interazioni sono state segnalate con tenoxicam o con altri antinfiammatori non steroidei:
- anticoagulanti orali o eparina: i FANS possono aumentare gli effetti degli anticoagulanti, come il warfarin (vedere “Precauzioni d’impiego”),
- agenti antiaggreganti ed inibitori selettivi del reuptake della serotonina (SSRIs): aumento del rischio di emorragia gastrointestinale (vedere “Precauzioni d’impiego”),
- litio: l’assunzione contemporanea può elevare la litiemia oltre la soglia di tossicità,
- metotrexate: potenziamento della tossicità ematologica del metotrexato,
- triamterene: peggioramento della funzionalità renale,
- ticlopidina: potenziamento dell’effetto antiaggregante.
Tali associazioni vanno pertanto evitate a meno che non siano ritenute strettamente indispensabili da parte del medico che deve procedere ad un opportuno aggiustamento del dosaggio al fine di evitare indesiderati effetti da potenziamento e sorvegliare attentamente le condizioni cliniche del paziente.
Evitare l’associazione con salicilati ed altri farmaci antiflogistici per l’aumentato rischio di effetti collaterali. La somministrazione contemporanea di corticosteroidi aumenta il rischio di ulcerazione o emorragia gastrointestinale (vedere “Avvertenze speciali”).
I FANS possono ridurre l’effetto dei diuretici e di altri farmaci antipertensivi. In particolare non si è rilevata un’interazione di significato clinico tra DOLMEN e furosemide, ma tenoxicam attenua l’effetto antipertensivo dell’idroclorotiazide. In comune ad altri farmaci antinfiammatori non steroidei, tenoxicam potrebbe ridurre l’effetto antipertensivo dei bloccanti alfa-adrenergici e degli ACE-
inibitori.
In alcuni pazienti con funzione renale compromessa (per esempio pazienti disidratati o pazienti anziani con funzione renale compromessa), la co-somministrazione di un ACE-inibitore o di un antagonista dell’angiotensina II e di agenti che inibiscono il sistema della ciclo-ossigenasi, può portare ad un ulteriore deterioramento della funzione renale, che comprende una possibile insufficienza renale acuta, generalmente reversibile. Queste interazioni devono essere considerate in pazienti che assumono DOLMEN in concomitanza con ACE-inibitori o antagonisti dell’angiotensina II.
Quindi, la combinazione deve essere somministrata con cautela, specialmente nei pazienti anziani.
I pazienti devono essere adeguatamente idratati e deve essere preso in considerazione il monitoraggio della funzione renale dopo l’inizio della terapia concomitante.
Non sono segnalate interazioni tra antinfiammatori non steroidei e alfa-adrenergici centrali o calcio antagonisti. La somministrazione concomitante di DOLMEN e atenololo non genera interazioni di rilevanza clinica. In corso di sperimentazioni cliniche non sono state riportate interazioni in pazienti trattati con digitalici. Pertanto la somministrazione contemporanea di DOLMEN e digossina appare scevra da seri eventi avversi.
In caso di contemporanea assunzione di farmaci contenenti potassio o di diuretici che determinano una ritenzione di potassio sussiste il rischio di un aumento della concentrazione potassica nel siero (iperpotassiemia).
Non sono state rilevate interazioni in caso di somministrazione concomitante di antiacidi, cimetidina, warfarin, ai dosaggi raccomandati.
L’efficacia clinica di antidiabetici orali (glibornuride, glibenclamide e tolbutamide) non viene modificata da DOLMEN. Allo stesso tempo si raccomanda un accurato monitoraggio in pazienti con concomitanti terapie a base di anticoagulanti o antidiabetici.
Non sono state rilevate interazioni di interesse clinico tra DOLMEN ed eparina a basso peso molecolare.
Pur su casistiche ridotte, non sono state rilevate interazioni di rilevanza clinica in soggetti con concomitanti trattamenti a base di sali d’oro, penicillamina o probenecid.
AVVERTENZE SPECIALI
L’uso di DOLMEN deve essere evitato in concomitanza di farmaci antinfiammatori non steroidei
(FANS), inclusi gli inibitori selettivi della COX-2.
Gli effetti indesiderati possono essere minimizzati con l’uso della dose minima efficace per la durata di trattamento più breve possibile che occorre per controllare i sintomi.
Relativamente alla forma iniettabile, il paziente deve consultare il proprio medico per essere istruito sulla più corretta modalità di somministrazione del farmaco.
Il prodotto, come tutti i farmaci antinfiammatori non steroidei, interferisce con la sintesi delle prostaglandine e di loro importanti intermedi che sono partecipi di funzioni fisiologiche.
Il farmaco, pertanto, richiede particolari precauzioni o se ne impone l’esclusione dall’uso allorché nel paziente siano presenti le seguenti condizioni: stati di ipoperfusione del rene, funzionalità epatica e/o renale ridotta, insufficienza cardiocircolatoria, ipertensione arteriosa, età avanzata.
Analogamente ci si comporterà in caso di alterazioni ematiche in atto o pregresse.
I medicinali così come DOLMEN possono essere associati ad un modesto aumento del rischio di attacco cardiaco (“infarto del miocardio”) o ictus. Qualsiasi rischio è più probabile con alte dosi e trattamenti prolungati. Non superare la dose o la durata del trattamento raccomandata.
Se si hanno problemi cardiaci, o precedenti di ictus o si pensa di poter essere a rischio per queste condizioni (p.es.: pressione sanguigna alta, diabete o colesterolo elevato o fumo) si deve discutere la terapia con il medico o il farmacista.
L’uso del farmaco in prossimità del parto determina il ritardo del parto stesso ed inoltre, se somministrato in tale periodo, può provocare alterazioni dell’emodinamica del piccolo circolo del nascituro con gravi conseguenze per la respirazione.
Per l’interazione del farmaco con il metabolismo dell’acido arachidonico, in asmatici o soggetti predisposti possono insorgere crisi di broncospasmo ed eventualmente shock ed altri fenomeni allergici.
Questo farmaco non può essere considerato un semplice antidolorifico e richiede di essere impiegato sotto lo stretto controllo del medico.
Inoltre, superato l’episodio doloroso acuto, è prudente passare all’impiego della preparazione per l’uso non parenterale che, pur dando qualitativamente gli stessi effetti collaterali, è meno incline a indurre reazioni gravi; l’eventuale impiego del farmaco per periodi più prolungati è consentito solo negli ospedali e case di cura.
Gravidanza ed allattamento
Gravidanza
L’inibizione della sintesi di prostaglandine può interessare negativamente la gravidanza e/o lo sviluppo embrio/fetale.
Risultati di studi epidemiologici suggeriscono un aumentato rischio di aborto e di malformazione cardiaca e di gastroschisi dopo l’uso di un inibitore della sintesi delle prostaglandine nelle prime fasi della gravidanza. Il rischio assoluto di malformazioni cardiache aumentava da meno dell’1%, fino a circa l’1,5%. E’ stato ritenuto che il rischio aumenta con la dose e la durata della terapia. Negli animali, la somministrazione di inibitori della sintesi di prostaglandine ha mostrato di provocare un aumento della perdita di pre e post-impianto e di mortalità embrione-fetale.
Inoltre, un aumento di incidenza di varie malformazioni, inclusa quella cardiovascolare, è stato riportato in animali a cui erano stati somministrati inibitori di sintesi delle prostaglandine, durante il periodo organogenetico.
Durante il terzo trimestre di gravidanza, tutti gli inibitori della sintesi di prostaglandine possono esporre il feto a: polmonare); la madre e il neonato, alla fine della gravidanza, a: occorrere anche a dosi molto basse;
- tossicità cardiopolmonare (con chiusura prematura del dotto arterioso e ipertensione
- disfunzione renale, che può progredire in insufficienza renale con oligo-idroamnios;
- possibile prolungamento del tempo di sanguinamento, ed effetto antiaggregante che può
- inibizione delle contrazioni uterine risultanti in ritardo o prolungamento del travaglio.
Allattamento
DOLMEN non va usato durante l’allattamento.
Effetti sulla capacità di guidare e di usare macchinari
I soggetti che hanno manifestato reazioni avverse che possono avere effetti sulla capacità di guidare e sull’uso dei macchinari, quali ad esempio vertigini, capogiri o disturbi della vista devono astenersi dalla guida o dall’uso di macchinari.
DOSE, MODO E TEMPO DI SOMMINISTRAZIONE
DOLMEN compresse, supposte e granulato per sospensione orale va somministrato alla dose di 20 mg una volta al giorno. Nei trattamenti a lungo termine la dose giornaliera di mantenimento può essere ridotta a 10 mg.
Nelle forme reumatiche acute la posologia raccomandata è di 40 mg al giorno per i primi due giorni, e successivamente, 20 mg una volta al giorno per 7-14 giorni.
DOLMEN 20 mg/2 mL polvere e solvente per soluzione iniettabile va somministrato endovena o intramuscolo alla dose di 20 mg al giorno. DOLMEN 40 mg/2 mL polvere e solvente per soluzione iniettabile è per solo uso intramuscolare.
Nelle forme reumatiche acute la terapia deve essere iniziata con 40 mg per via intramuscolare al giorno per i primi due giorni in dose unica o refratta.
Per il successivo trattamento la dose va ridotta a 20 mg al giorno; appena possibile per la terapia di mantenimento si dovrà ricorrere ad altre forme di somministrazione di DOLMEN.
Nel trattamento di pazienti anziani la posologia deve essere attentamente stabilita dal medico che dovrà valutare un’eventuale riduzione dei dosaggi sopraindicati.
Le iniezioni dovranno essere eseguite secondo rigorose norme di sterilizzazione, asepsi, antisepsi.
L’uso endovenoso di DOLMEN 20 mg/2 mL polvere e solvente per soluzione iniettabile è riservato agli ospedali e alle case di cura.
Sovradosaggio
In caso di sovradosaggio reale o presunto il farmaco va sospeso. Si devono adottare misure tendenti a ridurre l’assorbimento e ad aumentare la velocità di eliminazione. Le alterazioni gastrointestinali possono essere trattate con antiacidi e H 2-antagonisti. Se necessario l’eliminazione del tenoxicam può essere significativamente accelerata da 3 somministrazioni di 4 g di colestiramina.
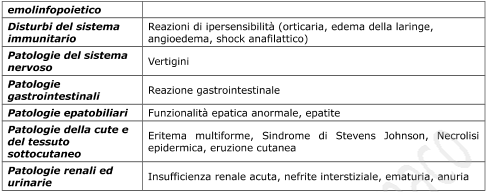
EFFETTI INDESIDERATI
Gli eventi avversi più comunemente osservati sono di natura gastrointestinale. Possono verificarsi ulcere peptiche, perforazione o emorragia gastrointestinale, a volte fatale, in particolare negli anziani (vedere “Precauzioni d’impiego”). Dopo somministrazione di DOLMEN sono stati riportati: nausea, vomito, diarrea, flatulenza, costipazione, dispepsia, bruciori, dolori gastrici ed addominali, melena, ematemesi, stomatiti ulcerative, senso di pienezza, secchezza delle fauci, esacerbazione di colite e morbo di Crohn (vedere “Precauzioni d’impiego”).
Meno frequentemente sono state osservate gastriti.
La frequenza di tali sintomi varia con l’aumento della posologia giornaliera.
Altri effetti segnalati possono essere: reazioni da ipersensibilità quali eruzioni cutanee, cefalea, vertigini, astenia, disturbi del sonno, alterazioni dei parametri ematologici, aumento dell’azotemia, delle BUN e della creatinina.
Raramente possono aggiungersi a queste reazioni: edemi allergici al viso, alle mani o generalizzati, aumento della fotosensibilità cutanea (prurito, arrossamento, eruzioni maculari e vescicolose), alterazioni visive, anemia aplastica, depressione del midollo osseo, trombocitopenia, aumento degli indici di funzionalità epatica (transaminasi e fosfatasi alcalina), ittero (sindrome colestatica), insufficienza renale acuta, ritenzione idrica che può manifestarsi sotto forma di edema, soprattutto agli arti inferiori, o disturbi cardiocircolatori (palpitazioni, ipertensione, scompenso cardiaco).
I medicinali così come DOLMEN possono essere associati ad un modesto aumento del rischio di attacco cardiaco (“infarto del miocardio”) o ictus.
Analogamente ad altri antinfiammatori non steroidei, in casi sporadici possono verificarsi ulcere perforanti, agranulocitosi, disturbi vescicali, shock e suo pre-stadio, insufficienza cardiaca acuta, caduta dei capelli ed alterazioni ungueali. Eruzioni cutanee potenzialmente letali (sindrome di Stevens-Johnson, necrolisi epidermica tossica) sono state segnalate con frequenza: molto rara, (vedere “Precauzioni d’impiego”). Sono stati segnalati, dopo somministrazione intramuscolare, dolore transitorio ed eritema nella sede dell’iniezione.
Si consiglia di consultare il medico o il farmacista in caso di comparsa di effetti indesiderati non previsti dal presente foglio illustrativo.
Modalità di conservazione
Attenzione: non utilizzare il medicinale dopo la data di scadenza indicata sulla confezione.
Data ultima revisione da parte dell’AIFA: Marzo 2012
06-2006 Dolmen 40 fiale/FI
Det. AIC/N/V n. 2087 del 15/09/09-Suppl. n. 184 alla G.U. n. 235 del 9/10/09 04-2010 Adeg. FI al testo RCP (art. 78 comma 1 al D.L.vo 219/06) 11-2011 Var. IB CI3a
Not. regolarità AIFA/V&A/P/25258 del 20/02/2012
G.U. n. 30 del 10/03/2012 (parte II)