BRIOFIL
600 mg compresse rivestite con film-250 mg supposte
Bamifillina
Elenco capitoli
- Denominazione della specialità medicinale
- Composizione
- Forma farmaceutica e confezioni
- Categoria farmacoterapeutica
- Indicazioni terapeutiche
- Controindicazioni
- Precauzioni d’impiego
- Effetti indesiderati
Denominazione della specialità medicinale
BRIOFIL.
Composizione
Compresse rivestite con film da 600 mg
Una compressa rivestita contiene: Principio attivo: Bamifillina cloridrato 600 mg.
Eccipienti: Idrossipropilcellulosa, talco, magnesio stearato, lacca protettiva polimetacrilica, idrossipropilmetilcellulosa (Methocel E5 Premium), titanio diossido E171,
polietilenglicole 6000, sodio saccarinato, vanillina.
Supposte da mg 250
Una supposta contiene: Principio attivo: Bamifillina cloridrato 250 mg.
Eccipienti: Gliceridi semisintetici solidi.
Forma farmaceutica e confezioni
Scatola da 30 compresse rivestite con film da 600 mg di principio attivo per uso orale.
Scatola da 10 supposte da 250 mg di principio attivo per uso rettale.
Categoria farmacoterapeutica
Antiasmatico per uso sistemico.
Nome ed indirizzo del titolare dell’A.I.C.
TEOFARMA S.r.l.
Via F.lli Cervi, 8-27010 Valle Salimbene (PV)
Nome ed indirizzo del produttore
TEOFARMA S.r.l.
V.le Certosa, 8/A-27100 Pavia
Indicazioni terapeutiche
Asma bronchiale, affezioni polmonari con componente spastica bronchiale.
Controindicazioni
Infarto miocardico acuto.
Ipersensibilità nota al prodotto ed ai derivati xantinici.
Precauzioni d’impiego
BRIOFIL va somministrato con cautela nei neonati e nella prima infanzia (evitando dosaggi elevati e ricordando di frazionare le supposte), nei casi di insufficenza cardiaca avanzata, ipertensione arteriosa grave, insufficienza epatica e renale, ulcera gastrica ed ipertiroidismo.
Le ricerche sul ciclo riproduttivo hanno evidenziato che la bamifillina cloridrato non influenza la fertilità, la gestazione, l’allattamento e lo sviluppo embrio-fetale.
Si consiglia comunque, per norma precauzionale, di evitare la somministrazione nei primi mesi di gravidanza.
Con l’impiego di bamifillina somministrata in gravidanza non si sono mai osservati casi di tossicità neonatale. Per precauzione comunque se ne sconsiglia l’impiego negli ultimi giorni di gravidanza e durante l’allattamento.
Interazioni con altri medicinali e di qualsiasi altro genere
Non sono note interazioni con bamifillina, tenere comunque presenti quelle note per la teofillina.
Eritromicina, TAO, lincomicina, clindamicina, allopurinolo, cimetidina, vaccino antinfluenzale, propanololo possono aumentare i tassi sierici di teofillina; fenitoina, altri anticonvulsivanti ed il fumo di sigaretta possono diminuire i tassi sierici di teofillina.
Il prodotto non dovrebbe essere somministrato contemporaneamente ad altri preparati xantinici.
Occorre usare cautela nel caso di associazione con efedrina o altri simpaticomimetici broncodilatatori.
TENERE FUORI DALLA PORTATA E DALLA VISTA DEI BAMBINI.
Posologia, modo e tempo di somministrazione
Adulti
Per via orale: generalmente una compressa rivestita da 600 mg al mattino ed alla sera prima dei pasti.
Bambini
Di età inferiore ai 2 anni: mezza supposta per 2 volte al giorno.
Di età superiore ai 2 anni: 1 supposta 2 volte al giorno.
Evitare la somministrazione ad intervalli ravvicinati.
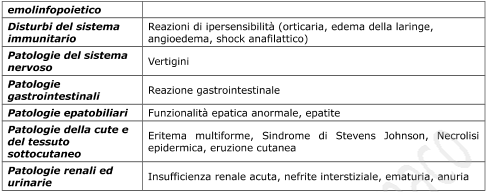
Effetti indesiderati
In qualche raro caso sono stati segnalati cefalea e gastralgia.
Dosi superiori a quelle terapeutiche possono indurre la comparsa di nausea e di fini tremori distali che scompaiono con la riduzione della posologia.
Sono state anche segnalate reazioni allergiche quali orticaria, prurito, rash, dermatite.
Qualora si verificasse qualsiasi effetto indesiderato più grave o diverso, questo dovrà essere prontamente comunicato al proprio medico curante.
Attenzione: non utilizzare il medicinale dopo la data di scadenza indicata sulla confezione.
Data dell’ultima revisione del foglio illustrativo da parte del Ministero della
Salute: Giugno 2010.