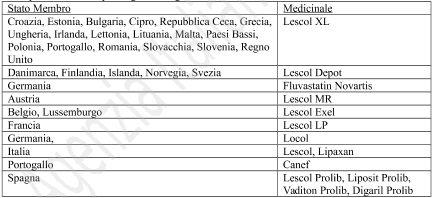
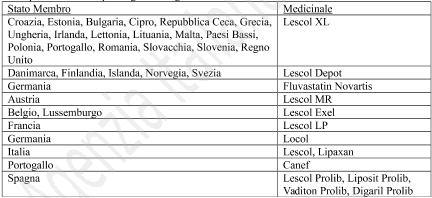
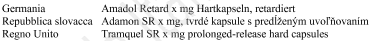KETOPLUS
200 mg capsule rigide a rilascio prolungato
Ketoprofene
Elenco capitoli
- CATEGORIA FARMACOTERAPEUTICA
- INDICAZIONI TERAPEUTICHE
- CONTROINDICAZIONI
- PRECAUZIONI PER L’USO
- INTERAZIONI
- AVVERTENZE SPECIALI
- SOVRADOSAGGIO
- EFFETTI INDESIDERATI
- SCADENZA E CONSERVAZIONE
- COMPOSIZIONE
- FORMA FARMACEUTICA E CONTENUTO
CATEGORIA FARMACOTERAPEUTICA
Antinfiammatorio/ antireumatico non steroideo
INDICAZIONI TERAPEUTICHE
Artrite reumatoide, spondilite anchilosante, gotta acuta; osteoartrosi a varia localizzazione, sciatalgie, radicoliti, mialgie, borsiti, tendinite, tenosinoviti, sinoviti, capsuliti, contusioni, distorsioni, lussazioni, strappi muscolari, flebiti, tromboflebiti superficiali, linfagiti; affezioni flogistiche dolorose in odontoiatria, otorinola-ringoiatria, urologia e pneumologia.
CONTROINDICAZIONI
KETOPLUS e controindicato nei pazienti con ipersensibilità al principio attivo o ad uno qualsiasi degli eccipienti.
KETOPLUS è controindicato nei pazienti che hanno una storia di reazioni di ipersensibilità come broncospasmo, attacchi d’asma, riniti, orticaria o altre reazioni di tipo allergico al ketoprofene, all’Acido Acetil Salicilico (ASA) o altri farmaci antiinfiammatori non steroidei (FANS).
Reazioni anafilattiche gravi, raramente fatali, sono state segnalate in questi pazienti (vedere paragrafo “Effetti Indesiderati”).
KETOPLUS è inoltre controindicato nel terzo trimestre di gravidanza, durante l’allattamento ed in età pediatrica (vedere paragrafo ”Gravidanza e Allattamento”)
KETOPLUS è controindicato nei seguenti casi:
- Grave insufficienza cardiaca
- Ulcera peptica / emorragia attiva o storia di ulcera peptica ricorrente / emorragia (due o più episodi distinti di dimostrata ulcerazione o sanguinamento)
- Storia di emorragia gastrointestinale o perforazione, relativa a precedente terapia con FANS
- Diatesi emorragica
- Grave Insufficienza epatica
- Grave insufficienza renale
KETOPLUS è inoltre controindicato in corso di terapia diuretica intensiva, dispepsia cronica, gastrite, leucopenia e piastrinopenia, in corso di trattamento con anticoagulanti in quanto ne sinergizza l‘azione, cirrosi epatica o epatiti gravi.
PRECAUZIONI PER L’USO
Il prodotto,come tutti gli antinfiammatori non steroidei, interferisce con la sintesi delle prostaglandine e di loro importanti intermedi che sono partecipi di funzioni fisiologiche.
Il farmaco, pertanto, richiede particolari precauzioni o se ne impone l’ esclusione dell’ uso allorché nel paziente siano presenti le seguenti condizioni: stati di ipoperfusione del rene, malattie renali, età avanzata.
Il medicinale non è controindicato per i soggetti affetti da malattia celiaca.
I pazienti con ulcera peptica attiva o una storia pregressa di ulcera peptica.
I FANS devono essere somministrati con cautela nei pazienti con una storia di malattia gastrointestinale (colite ulcerosa, morbo di Crohn) perché tali condizioni possono essere esacerbate (vedere paragrafo “Effetti Indesiderati”)
All’inizio del trattamento, la funzionalità renale deve essere attentamente monitorata nei pazienti con insufficienza cardiaca, cirrosi e nefrosi, nei pazienti in terapia con diuretici, in pazienti con insufficienza renale cronica, in particolare se il paziente è anziano. In questi pazienti, la somministrazione di KETOPLUS può provocare una riduzione del flusso sanguigno renale causata da inibizione delle prostaglandine e può condurre ad uno scompenso renale.
Un adeguato monitoraggio ed opportune istruzioni sono necessarie nei pazienti con anamnesi positiva per ipertensione c/o insufficienza cardiaca congestizia da lieve a moderata poiché in associazione al trattamento con i FANS sono stati riscontrati ritenzione di liquidi ed edema.
Come con altri FANS, in presenza di una infezione bisogna tenere in considerazione che le proprietà anti-infiammatorie, analgesiche e antipiretiche del ketoprofene possono mascherare gli abituali segni della progressione dell’infezione come la febbre.
Nei pazienti con alterazioni dei test di funzionalità epatica o con una storia di malattia epatica, i livelli delle transaminasi devono essere valutati periodicamente, in particolare durante la terapia a lungo termine.
Rari casi di ittero ed epatite sono stati descritti con KETOPLUS.
L’uso di FANS può ridurre la fertilità femminile e non è consigliato in donne che intendono iniziare una gravidanza. Nelle donne che hanno problemi di fertilità o che sono sottoposte ad indagini sulla fertilità, la somministrazione di KETOPLUS
deve essere sospesa.
Pazienti con asma associata a rinite cronica, sinusite cronica, e / o poliposi nasali hanno un rischio maggiore di allergia all’aspirina e / o ai FANS rispetto al resto della popolazione. La somministrazione di questo medicinale può causare attacchi di asma o broncospasmo, in particolare in soggetti allergici all’aspirina e/o ai FANS
(vedere paragrafo “ Controindicazioni”).
I pazienti con ipertensione non controllata, insufficienza cardiaca congestizia, cardiopatia ischemica accertata, malattia arteriosa periferica e/o malattia cerebrovascolare devono essere trattati con KETOPLUS, come con tutti i FANS,
soltanto dopo attenta valutazione. Analoghe considerazioni devono essere effettuate prima di iniziare un trattamento di lunga durata in pazienti con fattori di rischio per malattia cardiovascolare (es. ipertensione, iperlipidemia, diabete mellito, fumo).
Se si verificano disturbi visivi, come una visione offuscata, il trattamento deve essere interrotto.
INTERAZIONI
Informare il medico o il farmacista se si è recentemente assunto qualsiasi altro medicinale, anche quelli senza prescrizione medica.
Poiché il legame proteico del Ketoprofene è elevato, può essere necessario ri-durre il dosaggio di difenilidantoina o di sulfamidici che dovessero essere som-ministrati contemporaneamente.
Associazioni non raccomandate
Altri FANS (compresi gli inibitori selettivi della cicloossigenasi-2) e salicilati ad alte dosi
Aumentato rischio di ulcere e sanguinamento gastrointestinale
Anticoagulanti (eparina e warfarin)
I FANS possono amplificare gli effetti degli anticoagulanti.
Aumentato rischio di sanguinamento (vedere paragrafo “Avvertenze Speciali e Precauzioni per l’uso”)
Se la somministrazione concomitante è inevitabile, i pazienti devono essere attentamente monitorati.
Inibitori dell ’ aggregazione piastrinica (es. ticlopidina, clopidogrel)
Aumentato rischio di sanguinamento, aumento del rischio di emorragia gastrointestinale (vedere paragrafo 4.4)
Litio
Rischio di aumento dei livelli plasmatici di litio, che a volte possono raggiungere livelli tossici a causa della ridotta escrezione renale del litio. Dove necessario, i livelli plasmatici di litio devono essere attentamente monitorati e i livelli di dosaggio del litio regolati durante e dopo la terapia con i FANS.
Metotressato a dosi superiori di 15 mg/settimana
Aumentato rischio di tossicità ematica del metotressato, in particolare se somministrato ad alte dosi (> 15 mg/settimana), probabilmente correlato allo spostamento del metotrexato dalle proteine leganti e alla diminuzione della sua clearance renale.
Associazioni che richiedono cautela
Diuretici:
I pazienti in terapia con diuretici e, tra questi, pazienti particolarmente disidratati presentano un rischio più alto di sviluppare insufficienza renale secondaria ad una riduzione del flusso ematico renale causata da inibizione delle prostaglandine. Tali pazienti devono essere reidratati prima di iniziare la terapia concomitante e la funzionalità renale deve essere monitorata dopo l’inizio del trattamento (vedere sezione “ Avvertenze Speciali e Precauzioni per l’uso”).
ACE inibitori e antagonisti dell’angiotensina II
Nei pazienti con funzione renale compromessa (per esempio pazienti disidratati o pazienti anziani) la somministrazione concomitante di un ACE inibitore o di antagonisti dell’angiotensina II e di agenti che inibiscono la ciclo-ossigenasi può portare a un ulteriore deteriora-mento della funzionalità renale, che comprende una possibile insufficienza renale acuta.
Metotressato a dosi inferiori a 15 mg / settimana
Durante le prime settimane di trattamento combinato, la conta ematica completa deve essere monitorata settimanalmente.
Se vi è un’ alterazione della funzionalità renale o se il paziente è anziano, il monitoraggio deve essere fatto più spesso.
Corticosteroidi: aumento del rischio di ulcerazione gastrointestinale o sanguinamento (vedere sezione “Avvertenze Speciali e Precauzioni per l’uso”).
Pentossifillina
Aumentato rischio di sanguinamento. E’ richiesto un più frequente monitoraggio clinico e un monitoraggio del tempo di sanguinamento.
Associazioni da prendere in considerazione
Agenti antiipertensivi (beta-bloccanti, inibitori dell’enzima di conversione dell’angiotensina, diuretici)
Rischio di riduzione dell’effetto antipertensivo (inibizione delle prostaglandine vasodilatatorie da parte dei FANS).
Trombolitici
Aumentato rischio di sanguinamento.
Inibitori selettivi della ricaptazione della serotonina (SSRI)
Aumento del rischio di emorragia gastrointestinale (vedere paragrafo “Avvertenze
Speciali e Precauzioni per l’uso”).
Probenecid
La somministrazione concomitante di probenecid può notevolmente ridurre la clearance plasmatica del ketoprofene.
AVVERTENZE SPECIALI
L’uso di alcuni FANS come il KETOPLUS può essere associato ad un modesto aumento del rischio di attacco cardiaco (“infarto del miocardio”) o ictus. Qualsiasi rischio e’ più probabile con alte dosi e trattamenti prolungati. Non superare la dose o la durata del trattamento raccomandata.
Non ci sono dati sufficienti per escludere un rischio simile per Ketoprofene
Se ha problemi cardiaci, o precedenti di ictus o pensa di potere essere a rischio per queste condizioni (per esempio se ha pressione sanguigna alta, diabete o colesterolo elevato o fumo) deve discutere la sua terapia con il suo dottore o farmacista
L’uso concomitante di KETOPLUS con altri FANS, inclusi gli inibitori selettivi delle cicloossigenasi-2, deve essere evitato.
Gli effetti indesiderati possono essere minimizzati con l’uso della più bassa dose efficace per la più breve durata possibile di trattamento che occorre per controllare i sintomi.
Anziani: i pazienti anziani hanno una frequenza aumentata di reazioni avverse ai
FANS, specialmente emorragie e perforazioni gastrointestinali, che possono essere fatali (vedere paragrafo “Dose, modo e tempo di somministrazione”).
Emorragia gastrointestinale, ulcerazione e perforazione: durante il trattamento con tutti FANS, in qualsiasi momento, con o senza sintomi di preavviso o precedente storia di gravi eventi gastrointestinali, sono state riportate emorragia gastrointestinale, ulcerazione e perforazione, che possono essere fatali.
Alcune evidenze epidemiologiche suggeriscono che ketoprofene può essere asso-ciato a un elevato rischio di grave tossicità gastrointestinale, rispetto ad altri FANS,
soprattutto ad alte dosi (vedere anche sezione “Dose, modo e tempo di somministrazione ” e “Controindicazioni”).
Negli anziani e in pazienti con storia di ulcera, soprattutto se complicata da emorragia o perforazione (vedere sezione “ Controindicazioni”), il rischio di emorragia gastrointestinale, ulcerazione o perforazione è più alto con dosi aumentate di FANS.
Questi pazienti devono iniziare il trattamento con la più bassa dose disponibile.
L’uso concomitante di agenti protettori (misoprostolo o inibitori di pompa protonica) deve essere considerato per questi pazienti e anche per pazienti che assumono basse dose di aspirina o altri farmaci che possono aumentare il rischio di eventi gastrointestinali (vedere sotto e paragrafo “Interazioni”).
Pazienti con storia di tossicità gastrointestinale, in particolare anziani, devono riferire qualsiasi sintomo addominale (soprattutto emorragia gastrointestinale) in particolare nelle fasi iniziali del trattamento.
Cautela deve essere prestata ai pazienti che assumono farmaci concomitanti che potrebbero aumentare il rischio di ulcerazione o emorragia, come corticosteroidi orali, anticoagulanti come warfarin, inibitori selettivi del reuptake della serotonina o agenti antiaggreganti come l’aspirina (vedere sezione “Interazioni”).
Quando si verifica emorragia o ulcerazione gastrointestinale in pazienti che assumono KETOPLUS il trattamento deve essere sospeso.
Gravi reazioni cutanee alcune delle quali fatali, includenti dermatite esfoliativa, sindrome di Stevens-Johnson e necrolisi tossica epidermica, sono state riportate molto raramente in associazione con l’uso dei FANS. Nelle prime fasi della terapia i pazienti sembrano essere a più alto rischio. L’insorgenza della reazione si verifica nella maggior parte dei casi entro il primo mese di trattamento.
KETOPLUS deve essere interrotto alla prima comparsa di rash cutaneo, lesioni della mucosa o qualsiasi altro segno di ipersensibilità.
Gravidanza e allattamento
Chiedere consiglio al medico o al farmacista prima di prendere qualsiasi medicinale.
Gravidanza
L’inibizione della sintesi di prostaglandine può interessare negativamente la gravidanza e/o lo sviluppo embrio-fetale.
Risultati di studi epidemiologici suggeriscono un aumentato rischio di aborto e di malformazione cardiaca e di gastroschisi dopo l’uso di un inibitore della sintesi delle prostaglandine nelle prime fasi della gravidanza. Il rischio assoluto di malformazioni cardiache aumentava da meno dell’1% fino a circa l’1,5%.
E’ stato ritenuto che il rischio aumenta con la dose e la durata della terapia. Negli animali, la somministrazione di inibitori della sintesi di prostaglandine ha mostrato di provocare un aumento della perdita di pre e post-impianto e di mortalità embrione-fetale.
Inoltre, un aumento di incidenza di varie malformazioni, inclusa quella cardiova-scolare, è stato riportato in animali a cui erano stati somministrati inibitori di sintesi delle prostaglandine, durante il periodo organogenetico.
Nel corso del primo e secondo trimestre di gravidanza, KETOPLUS non deve essere somministrato se non è strettamente necessario. Se KETOPLUS viene utilizzato da una donna che intende concepire, o durante il primo e secondo trimestre di gravidanza, il dosaggio deve essere mantenuto basso e la durata del trattamento il più breve possibile.
Durante il terzo trimestre di gravidanza, tutti gli inibitori delle sintesi di prosta-glandine possono esporre il feto a:
- tossicità cardiopolmonare (con chiusura prematura del dotto arterioso e iperten-sione polmonare);
- disfunzione renale, che può progredire in insufficienza renale oligo-idroamnios; la madre e il neonato, alla fine della gravidanza, a:
- possibile prolungamento del tempo di sanguinamento, ed effetto antiaggre gante che può occorrere anche a dosi molto basse;
- inibizione delle contrazioni uterine risultanti in ritardo o prolungamento del tra-vaglio.
Di conseguenza, KETOPLUS è controindicato durante il terzo trimestre di gravidanza.
La somministrazione di Ketoprofene, anche se sperimentalmente non ha fatto osservare tossicità embriofetale per posologie rapportabili a quelle previste per l’ uso clinico, non è consigliabile in gravidanza,durante l’allattamento e nell’ infanzia.
L’uso del farmaco in prossimità del parto determina il ritardo del parto stesso; inoltre, se somministrato in tale periodo, può provocare alterazione dell’ emodinamica del piccolo circolo del nascituro con gravi conseguenze per la re-spirazione.
La somministrazione di KETOPLUS dovrebbe essere sospesa nelle donne che hanno problemi di fertilità o che sono sottoposte a indagini sulla fertilità.
Allattamento
Non sono disponibili dati sulla secrezione di ketoprofene nel latte materno.
KETOPLUS non è raccomandato nelle donne che allattano.
Effetti sulla capacità di guidare veicoli e sull’ uso di macchinari
I pazienti devono essere avvertiti circa la potenziale comparsa di sonnolenza, capogiri o convulsioni e avvisati di non guidare veicoli o usare macchinari qualora tali sintomi si verifichino.
DOSE, MODO E TEMPO DI SOMMINISTRAZIONE
1 capsula da 200 mg al giorno.
La posologia deve essere adattata in base alle severità della sintomatologia.
Si consiglia di assumere la capsula con un po’ d ‘acqua durante il pasto.
La dose massima giornaliera è 200 mg. Il rapporto rischio e beneficio deve es sere attentamente considerato prima di iniziare il trattamento con la dose giornaliera di 200 mg, e dosi più alte non sono raccomandate
SOVRADOSAGGIO
Casi di sovradosaggio sono stati riportati con dosi superiori a 2,5 g di ketoprofene.
Nella maggior parte dei casi, i sintomi osservati sono stati benigni e limitati a letargia, sonnolenza, nausea, vomito e dolore epigastrico.
Non vi sono antidoti specifici per il sovradosaggio da ketoprofene. In caso di sospetto sovradosaggio massiccio, è consigliata una lavanda gastrica e si rende necessario un trattamento sintomatico e di supporto per compensare la disidratazione, monitorare l’escrezione urinaria e correggere l’acidosi, se presente.
In caso di insufficienza renale, può essere utile l’emodialisi per rimuovere il medicinale circolante.
EFFETTI INDESIDERATI
Come tutti i medicinali, KETOPLUS può causare effetti indesiderati sebbene non tutte le persone li manifestino.
Apparato gastrointestinale: gli eventi avversi più comunemente osservati sono di natura gastrointestinale.
Possono verificarsi ulcere peptiche, perforazione o emorragia gastrointestinale, a volte fatale, in particolare negli anziani (vedere paragrafo “Avvertenze speciali”).
Dopo somministrazione di KETOPLUS sono stati riportati: nausea, vomito, diarrea, flatulenza, costipazione, dispepsia, dolore addominale, melena, ematemesi, stomatiti ulcerative, esacerbazione di colite e morbo di Crohn (vedere paragrafo “Avvertenze speciali”)
Meno frequentemente sono state osservate gastriti.
Classificazione delle frequenze attese:
Molto comune (≥ 1/10), comune (≥ 1/100 a <1/10), non comune ((≥ 1/1. 000 a
<1/100), raro (≥ 1/10.000 a <1/1.000), molto raro (<1/10.000), non nota (non può essere definita sulla base dei dati disponibili).
Le seguenti reazioni avverse sono state riportate con ketoprofene negli adulti:
Patologie del sistema emolinfopoietico
- Raro: anemia emorragica
- Non nota: agranulocitosi, trombocitopenia, danno del midollo osseo
Disturbi del sistema immunitario
- Non nota: reazioni anafilattiche (incluso lo shock)
Disturbi psichiatrici
- Non nota: alterazioni dell’umore
Patologie del sistema nervoso
- Non comune: mal di testa, vertigini, sonnolenza
- Raro: parestesia
- Non nota: convulsioni, disgeusia
Patologie dell’occhio
- Raro: visione offuscata (vedere paragrafo “ Avvertenze Speciali e Precauzioni per l’uso”)
Patologie dell’orecchio e del labirinto
- Raro: tinnito
Patologie cardiache
- Non nota: insufficienza cardiaca
Patologie vascolari
- Non nota: ipertensione, vasodilatazione
Patologie respiratorie, toraciche e mediastiniche
- Raro: asma
- Non nota: broncospasmo (particolarmente in pazienti con nota ipersensibilità all’ ASA e altri FANS), rinite
Patologie gastrointestinali
- Comune: dispepsia, nausea, dolore addominale, vomito
- Non comune: costipazione, diarrea, flatulenza, gastrite
- Raro stomatite, ulcera peptica
- Non nota: esacerbazione di colite e morbo di Crohn, emorragia e perforazioni gastrointestinali, melena ed ematemesi
Patologie epatobiliari
- Raro: epatite, aumento delle transaminasi, aumento dei livelli sierici di bilirubina dovuto a disturbi epatici
Patologie della cute e del tessuto sottocutaneo
- Non comune: eruzione cutanea, prurito
- Non nota: reazioni di fotosensibilità, alopecia, orticaria, angioedema, eruzioni bollose comprese la sindrome di Stevens-Johnson e necrolisi epidermica tossica
Patologie renali e urinarie
- Non nota: insufficienza renale acuta, nefrite tubulo-interstiziale, sindrome nefritica, test di funzionalità renale anomali
Patologie sistemiche e condizioni relative alla sede di somministrazione
- Non comune: edema, affaticamento
Esami diagnostici
- Raro: aumento di peso
Studi clinici e dati epidemiologici suggeriscono che l’uso di alcuni FANS
(specialmente ad alti dosaggi e per trattamenti di lunga durata) può essere associato ad un modesto aumento del rischio di eventi trombotici arteriosi (p.es. infarto del miocardio o ictus) (vedere sezione “Avvertenze Speciali e Precauzioni per l’uso).
Il rispetto delle istruzioni contenute nel foglio illustrativo riduce il rischio di effetti indesiderati.
Se uno qualsiasi degli effetti indesiderati si aggrava, o se si nota la comparsa di un qualsiasi effetto indesiderato non elencato in questo foglio illustrativo, informare il medico o il farmacista
SCADENZA E CONSERVAZIONE
Scadenza: vedere la data di scadenza indicata sulla confezione
Attenzione: non utilizzare il medicinale dopo la data di scadenza indicata sulla confezione
La data di scadenza indicata si riferisce al prodotto in confezionamento integro correttamente conservato.
Conservazione a temperatura non superiore a 30° C.
I medicinali non devono essere gettati nell’acqua di scarico e nei rifiuti domestici.
Chiedere al farmacista come eliminare i medicinali che non si utilizzano più.
Questo aiuterà a proteggere l’ambiente.
Tenere il medicinale fuori dalla portata e dalla vista dei bambini.
COMPOSIZIONE
Una capsula a rilascio prolungato contiene:
Principio attivo: Ketoprofene mg 200
Eccipienti: microgranuli di saccarosio e amido, povidone K30 poli(metil) metacrilati (Eudragit RS), talco.
Costituenti della capsula: gelatina, titanio biossido (E171).
FORMA FARMACEUTICA E CONTENUTO
Capsule rigide a rilascio prolungato contenenti 200 mg di Ketoprofene confezione da 28 capsule
TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO
S.F. Group srl
Via Beniamino Segre n.59-00134 Roma
PRODUTTORE
APTALIS PHARMA S.r.l.
Via Marche n. 9-20098 San Giuliano Milanese (MI)
Confezionato e controllato da
SPECIAL PRODUCT’S LINE Srl
Via Campobello, 15-Pomezia (Roma)
LA.FA.RE. Srl
Via Sac. Benedetto Cozzolino, 77 – Ercolano (NA)
REVISIONE DEL FOGLIO ILLUSTRATIVO DA PARTE DELL’AGENZIA ITALIANA DEL FARMACO: 22 febbraio 2013